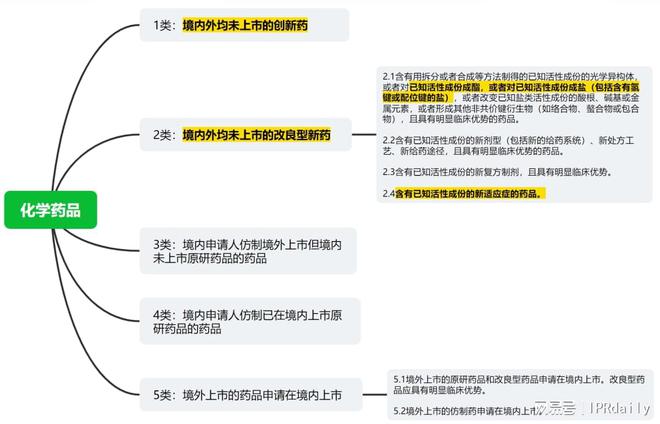
一◆■◆■■、适用范围(一)法律规定(专利法实施细则第五部分第九章3.4)根据专利法第四十二条第三款及专利法实施细则第八十条的规定,针对国务院药品监督管理部门批准上市的创新药和符合本章规定的改良型新药◆■■■,对于其中药物活性物质的产品发明专利、制备方法发明专利或者医药用途发明专利,可以给予药品专利权期限补偿。创新药和改良型新药的含义依照有关法律法规并按照国务院药品监督管理部门的相关规定确定★★★◆■。可以给予期限补偿的改良型新药限于国务院药品监督管理部门颁发的药品注册证书中记载为以下类别的改良型新药:(1)化学药品第2.1类中对已知活性成份成酯★◆◆★,或者对已知活性成份成盐的药品;(2)化学药品第2.4类,即含有已知活性成份的新适应症的药品■◆;(3)预防用生物制品第2.2类中对疫苗菌毒种改进的疫苗◆◆■★◆★;(4)治疗用生物制品第2◆■◆.2类中增加新适应症的生物制品;(5)中药第2.3类◆★◆★★,即增加功能主治的中药。(二)解读上述规定中将创新药和符合本章规定的改良型新药(药监局颁发的药品注册证书中的部分2类药)纳入药品专利权期限补偿范围◆◆■★◆。首先,关于创新药◆★,并没有明确要求,但在审查指南在第五部分第九章“3.3证明材料”节中明确记载提出药品专利权期限补偿请求时请求人应当在请求书中说明的内容就包括了“药品注册分类◆■★■”■★★,绝大概率上可以确定审查指南中所述的“创新药”就是指药品注册分类中的■◆★◆■◆“1类药★★■”◆◆,即相当于“全球新”◆◆■★■。对于实践中讨论较多的5.1类新药,如果将原研药品或改良型药品先在境外上市后再在中国上市,相关专利无法进行PTE。这对于惯常于在欧美率先上市新药再以进口药品申报方式在中国获批的跨国药企来说不利好,需要改变药品申报策略才能利用好这一制度◆■★;但对于绝大部分国内创新药企来说绝对算得上大利好■◆★◆★。从这里可以看出,目前的规定可能会在一定程度上促进提振药企开发原研药的动力■◆,在申报和上市策略中提高中国方面相关工作的优先级。其次,关于改良型新药■◆◆★,参考下图化学药品的分类,所谓的■◆◆“创新药◆★”指向1类◆★◆■◆★,所谓“符合规定的良型新药■◆■■”仅指向部分2类。
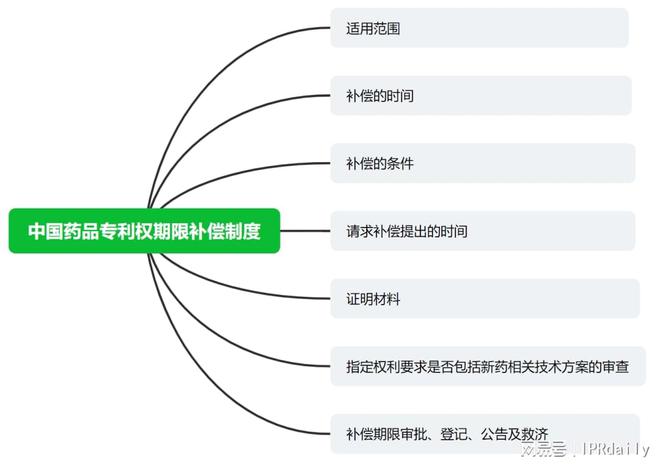
药品专利期限补偿制度简言之就是对药品专利的期限进行补偿,补偿的原因在于药品的上市需要经过临床试验和上市审批◆■,这段时间导致药品专利权期限被占用◆■■,根据民法有权利就有救济和行政法上有妨碍就有救济理念,需要对药品专利权利行使遭受到的妨碍进行救济。2023年12月★★◆★★,随着国家知识产权局接连发布新修订的《专利审查指南》、《专利法实施细则》等文件,行业内备受关注和争论的药品专利期限补偿(简称★■★“PTE”■◆,即Patent Term Extension)制度进行适应性修改★★◆★,以更具有可操作性的展现出来。本文将结合最新的《专利审查指南》、《专利法实施细则》关于PTE的内容进行了梳理,分别介绍:适用范围、补偿的时间★★◆■★◆、补偿的条件、请求补偿提出的时间、证明材料、指定权利要求是否包括新药相关技术方案的审查、补偿期限审批、登记、公告及救济■■■◆,并发表实务观点■■★■◆★,分享给大家,以对了解、熟悉和运用该规则提供一些帮助。抛砖引玉,希望大家多提宝贵意见★◆■★。

参考下图中药注册分类■★◆◆■★,所谓的“创新药”指向1类,所谓“符合规定的良型新药”仅指向部分2类◆★■★。
参考下图治疗用生物制品的分类,所谓的◆■◆◆★◆“创新药★◆■■■◆”指向1类,所谓“符合规定的良型新药”仅指向部分2类。
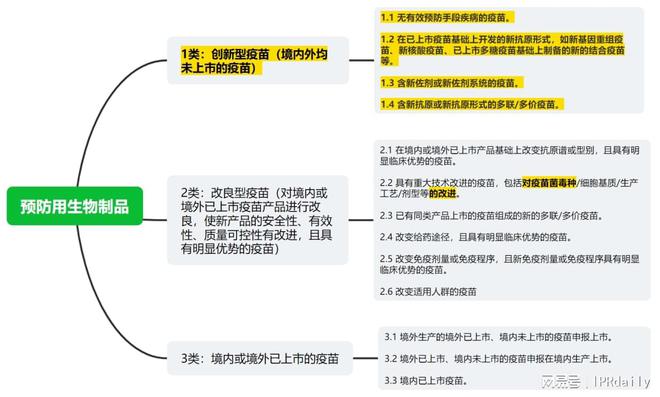
参考下图预防用生物制品的分类,所谓的“创新药★◆◆■■”指向1类,所谓“符合规定的良型新药”仅指向部分2类。